研究概要 Reserch
1. 大気汚染物質曝露による神経疾患の修飾
大気汚染地域に住んでいる人は、清澄な環境で暮らしている人に比べて脳梗塞やてんかん、神経変性疾患などの中枢神経系疾患が重篤化することが疫学的研究より明らかとなってきました。大気汚染物質の主な成分はPM2.5に代表される微粒子状物質であるため、これら大気中微粒子が脳に器質的変化をもたらし、この状態で疾患が発症するために、通常(微粒子に曝露していない)の状態に比べて疾患が増悪すると考えられます。私たちは、このような大気中微粒子による神経系のへの脆弱性の付加を『微粒子プライミング』とし、本態の解明を目指しています。
これまでの研究により、PM2.5を吸入したマウスにおいて、脳内の免疫担当細胞であるミクログリアが活性化し、神経炎症を引き起こしていることが明らかになりました。この活性化は、PM2.5から多環芳香族炭化水素を取り除くと抑制されること、また遺伝的に多環芳香族炭化水素が作用しないマウスではミクログリア活性化が生じなかったことから、PM2.5に付着している多環芳香族炭化水素が炎症を引き起こしていることが分かりました。
PM2.5に曝露しているマウスに脳梗塞を誘導すると、清澄な環境で飼育したマウスと比較して、脳梗塞後の神経炎症が増悪し運動機能障害が悪化することが明らかとなりました。多環芳香族炭化水素をPM2.5から取り除く、或いは多環芳香族炭化水素が作用しないマウスを用いると、PM2.5曝露による脳梗塞に伴う炎症の増悪と脳梗塞予後の悪化が抑制されました。これらの結果から、PM2.5は中枢神経系で炎症を引き起こし、脳梗塞による炎症とPM2.5による炎症が相加的に作用して、脳梗塞の予後が悪化すると推測されました(Particle Fibre Toxicol. 20:6 2023)。
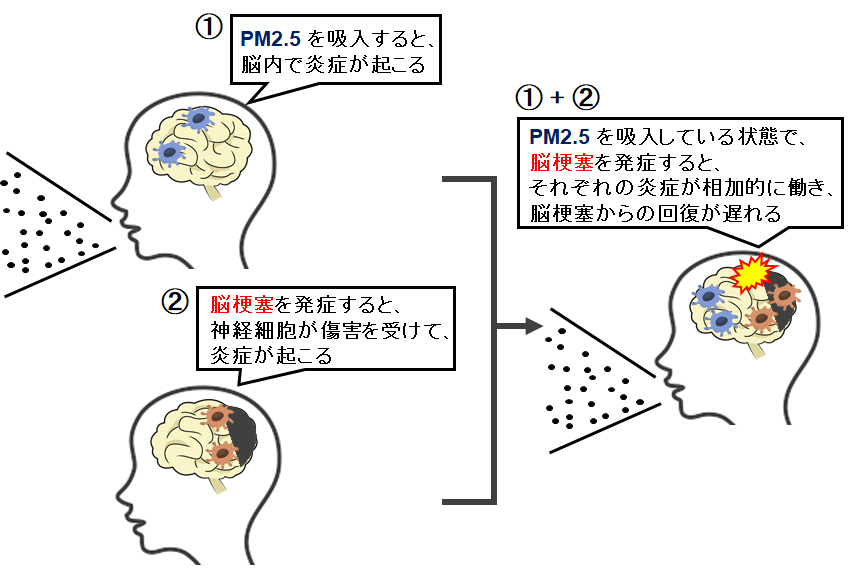
PM2.5の神経影響を調べるにあたり、最大の謎は「曝露したPM2.5がどのような経路で脳に影響するか」であると考えています。現在、脳梗塞以外の疾患、特にアルツハイマー病に着目し、PM2.5が脳に影響するメカニズムも含めて、大気汚染によりアルツハイマー病がどのように修飾されるか調べています。
2. 大気中マイクロプラスチックの健康影響の解明
直径5 mm以下のプラスチック片はマイクロプラスチック(microplastics: MPs)と呼ばれ、その多くは海洋に存在し、生物の誤食など生態影響が生じることが明らかになりつつあります。一方、MPsは大気中にも一定量浮遊しており、繊維状や球状、ポリプロピレンやポリエチレンテレフタレートなど、様々な形状や材質のMPsが観察されます。大気中MPsの主な標的は、気管支や肺などの呼吸器系、さらに常に大気に露出している皮膚であると考えられますが、その健康影響はほとんど明らかにされていません。私たちは、大気中MPsの健康影響について、特に呼吸器影響と免疫影響に関する研究を進めています。プラスチックのどのような特性が毒性と関連するのか明らかではありませんが、私たちはプラスチックが環境中で光や熱により劣化することに着目し、劣化MPsの生体影響を調べています。
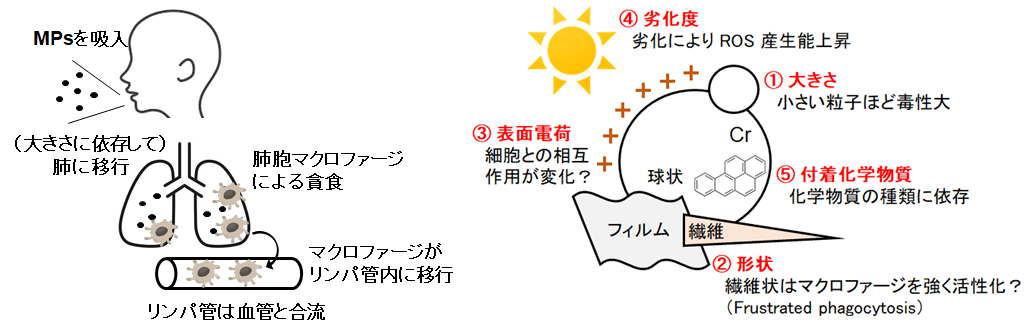
3.化学物質発達期曝露による神経影響の解析
医療や産業に使われている化学物質の中には、胎児期や乳幼児期の曝露により、成長後の行動異常を引き起こすものが少なからず存在します。例えば、妊娠中に抗てんかん薬バルプロ酸(VPA)を服用すると、児の知能指数(IQ)低下や自閉症のリスクが上昇することが報告されていますし、電気機器の絶縁油として使われたポリ塩化ビフェニル(PCBs)の胎児期曝露は生後の記憶・学習障害や社会行動の異常の原因となることが示唆されています。このような化学物質の神経影響については、ニューロンの電気的活動や移動(migration)に焦点が当てられ研究されてきましたが、メカニズムの大部分は未解明です。
神経回路の連結部であるシナプスは、発生の過程で過剰に形成され、ミクログリアという脳内の免疫担当細胞によって不要なものが刈り込まれる(貪食される)ことが知られています。つまり、発達期のミクログリア活性が異常(過活性化或いは抑制)となると、異常な神経回路網が形成されると考えられます。
私たちは、妊娠中にバルプロ酸を摂取したマウスの解析を進めています。妊娠中期に一度だけバルプロ酸を投与したマウスから産まれてきた仔は、成長後に空間認知機能の障害や社会性の異常など、発達障害様の行動を示しました。このような仔の海馬(学習行動などに関与する脳部位)では炎症が生じており、その神経細胞の興奮状態が異常に高まっていました。バルプロ酸を妊娠期に投与したマウスから産
まれてきた仔の海馬で発現が変化する遺伝子を網羅的に調べたところ、炎症性ケモカインの一つであるCCL3 の発現が上昇していることを突き止めました。CCL3 の受容体であるCCR5 を阻害するマラビロク(ヒト免疫不全ウイルス(HIV)感染症治療薬)を授乳期に投与したところ、神経細胞の興奮を鎮めることができ、成長後の発達障害様の行動を示さなくなりました。従って、脳内ケモカインCCL3はバルプロ酸による発達障害の原因分子であると考えられます(J Neuroinflam. 19:195, 2022)。
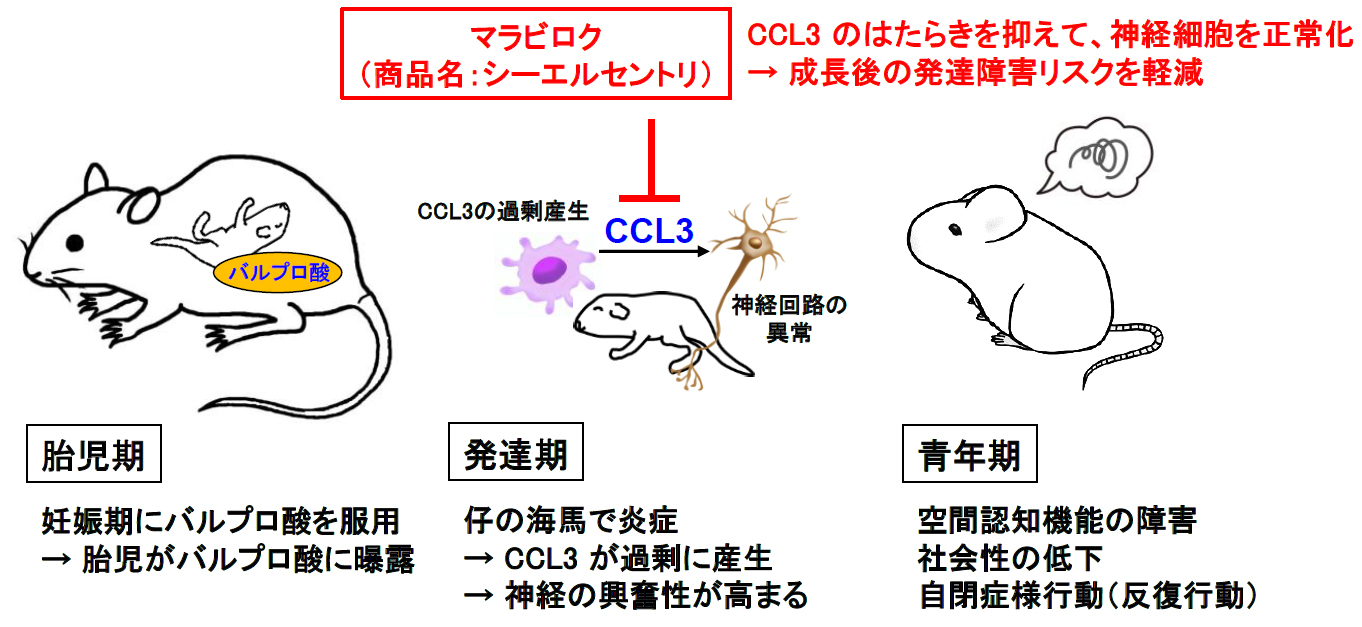
脳内のケモカインの役割には不明な点が多いのですが、農薬やダイオキシン類など、様々な化学物質の認識曝露により、脳内でケモカインが増えることが分かってきました。私たちは、脳内ケモカインで化学物質による発達障害がある程度は説明できるのではないかと考え、研究を継続しています。また、当初、ミクログリア-ニューロンの細胞間相互作用に着目していましたが、ミクログリア-オリゴデンドロサイト間の情報伝達が関わっているような結果が得られており、面白い成果が得られつつあります。
4.不飽和脂肪酸による神経保護と栄養学的神経疾患予防への応用
日本人が古来より摂取してきた魚には、脳の健康に欠かすことのできない栄養分がたくさん含まれています。そのなかでも、魚油に大量に含まれるn-3系高度不飽和脂肪酸であるドコサヘキサエン酸(DHA)は、他の組織に比べて脳に非常に多く存在し、DHA は神経細胞の細胞膜流動性の改善作用や、抗酸化能や抗炎症作用が報告されたことから、脳の健康維持に必須の分子であると考えられています。しかし、DHA の脳内での役割は完全に解明された訳ではありません。
私たちは、DHAを摂取させたマウスの解析から、DHA を摂取すると脳内で女性ホルモンであるエストラジオール量が大きく増加することを発見しました。このエストラジオール増加は、エストラジオール合成酵素であるCYP19の発現上昇に起因すること、脳内のエストラジオールはけいれん発作に対して抑制的に働くことを明らかにしてきました(Sci Rep 7:6268,2017)。最近は熱性けいれんモデルマウスを実験に使用し、妊娠期のDHA摂取が熱性けいれんの発症を抑制することを示しました(Epilepsy Behav. 121:108038, 2021)。また、複雑性熱性けれんという重篤な熱性けいれんを発症した場合、成長後にてんかんを罹患するリスクが増大することが知られていますが、DNAの新生児期の摂取は、熱性けいれん後のけいれん感受性の増大を抑制しました(Kawano et al. Biol Pharm Bull, 2023.)。この結果は、DHAを摂取しておくと、熱性けいれん後のてんかん発症リスクが低減することを示しています。
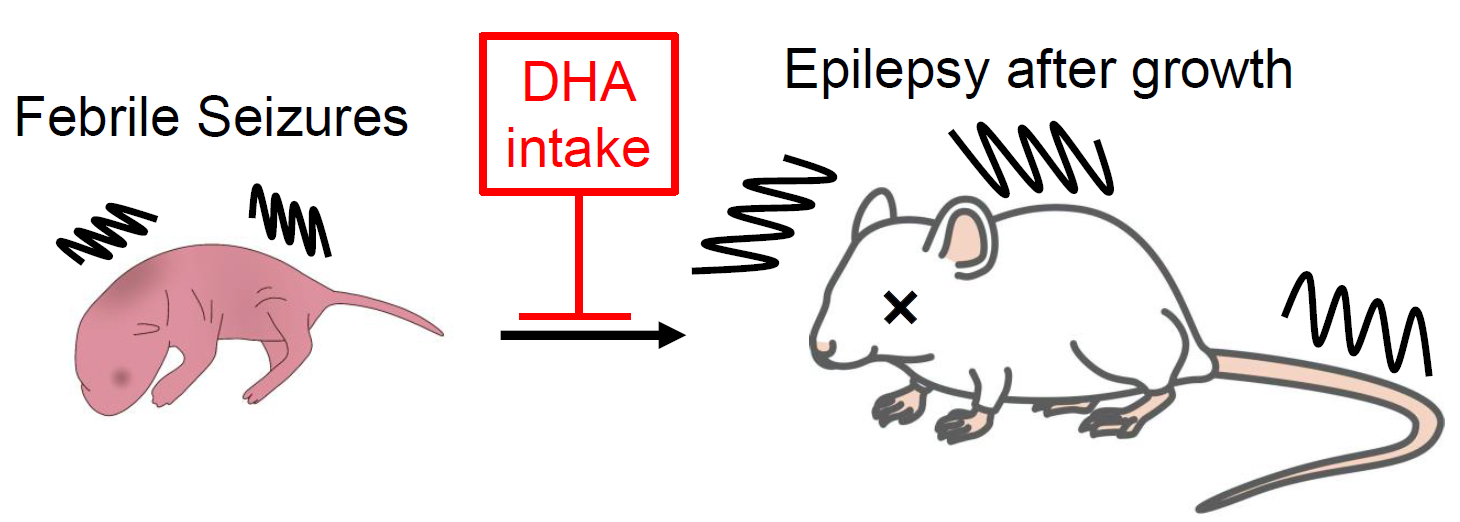
現在、ヒト検体を用いた検討を進めるとともに、DHAの作用について詳細なメカニズムを検討しています。
